Валентност. Разгледайте и обърнете внимание на структурните формули на хлороводорода, водата, амоняка и метана.
От тях се вижда че в молекулата на хлороводорода хлорният атом е свързан с една валентна връзка с водородния атом. Той е от първа валентност. В молекулата на водата кислородният атом се свързва с два водородни атома, т.е. с две единични валентни връзки и е от втора валентност. Азотния атом в молекулата на амоняка се свързва с три единични валентни връзки с трите водородни атома и е от трета валентност, а въглеродният атом в молекулата на метана се свързва с четири водородни атома с четири единични връзки и е от четвърта валентност.
При образуване на химичните връзки в разглежданите примери водородният и хлорният атом участват с по един електрон, кислородният – с два, азотният – с три, а въглеродният с четири електрона. Следователно валентността на елемента се определя от броя на електроните, с които неговият атом участва в образуването на химични връзки с атомите на други елементи в химичните съединения.
При образуване на химичната връзка в натриевия хлорид натриевият атом и хлорният атом участват с по един електрон. Затова и натрият, и хлорът са от първа валентност.
Валентността е свойството на атомите на химичните елементи да участват в образуване на химични връзки с други елементи с определен брой електрони. Валентността се определя от броя на тези електрони.
Някой елементи образуват химични връзки не само с единичните си електрони, а и с електрони от електронните си двойки и затова проявяват променлива валентност. Например атома на въглерода има във външния си електронен слой една неопределена двойка и два единични електрона ![]()
При образуването на химични връзки се разкъсва електронна двойка и той може да участва и с четирите си електрона. В тези случаи въглеродът се намира във възбудено състояние и проявява четвърта валентност.
Електроните, които могат да участват в образуване на химични връзки, се наричат валентни електрони.
Степен на окисление. Зарядът, който атомите получават при образуване на химичните връзки в съединенията, е от значение за характеризиране на някои от свойствата на тези съединения. Ето защо е въведено понятието степен на окисление.
До погледнем и обсъдим отново примера с молекулите на хлороводорода. Знаем, че поради разликата в електроотрицателността на елементите водородният атом е зареден частично положително, а хлорният – частично отрицателно (Hδ+ → Clδ-). Ако допуснем, че общата електронна двойка напълно е изтеглена към хлорния атом, то той би се превърнал в отрицателен йон с единица отрицателен електричен заряд, а водородният атом – в положителен йон с единица положителен електричен заряд. Съединението би се превърнало в йонно. Зарядите които биха придобили водородният и хлорният атом, характеризират степените им на окисление. За водорода тя е положителна първа степен на окисление, а за хлора тя е отрицателна първа степен на окисление.
В съединение с ковалентна полярна химична връзка степента на окисление на елементите е равна на заряда, които биха придобили атомите, ако съединението се разглежда като йонно.
В натриевия хлорид химичната връзка е йонна и натриевият йон притежава един положителен електричен заряд, а хлорният йон – един отрицателен електричен заряд. В натриевия хлорид степента на окисление на натрия е положителна първа, ана хлора – отрицателна първа.
В йонните съединения степента на окисление съвпада със заряда на йоните.
В молекулите на простите вещества водород (H2), хлор (Cl2), азот (N2) и други общата електронна двойка принадлежи еднакво и на двата атома. Връзката е ковалентна неполярна. В тези случаи степента на окисление на атомите е равна на нула. И в простите вещества с кристален строеж – натрий, калций, диамант, сяра, степента на окисление на атомите е нула.
В молекулите на простите вещества и в простите вещества с кристален строеж степента на окисление на атомите е равна на нула.
Означаване на степента на окисление. Степените на окисление се означават със знак „+“ или „-“ и съответната цифра записани над химичния знак на елемента например: ![]() . Последното се чете: Степента на окисление на натрия в натриевия хлорид е положителна първа, а на хлора отрицателна първа. В простото вещество азот степента на окисление на азота е нулева.
. Последното се чете: Степента на окисление на натрия в натриевия хлорид е положителна първа, а на хлора отрицателна първа. В простото вещество азот степента на окисление на азота е нулева.
Определяне на степента на окисление. Има различни правила за определяне на степента на окисление.
Чрез структурните формули. Структурната формула се записва, когато е позната структурата на молекулата. След това полярността на всяка химична връзка се представя със стрелки. Стрелките, които излизат от знака на даден елемент, показват положителните заряди, които биха се създали при изтеглянето на електронните двойки. Стрелките, които са насочени от други елементи към знака на елемента, определят съответните му отрицателни заряди. Степента на окисление се пресмята като сума от броя на даден вид стрелки.
Например за молекулата на водата (H→O←H): за водата степента на окисление е първа положителна, защото в структурната формула на водата от знака на елемента излиза по една стрелка, а кислородът е втора отрицателна степен на окисление, защото в структурната формула двете стрелки са насочени към него.
В молекулата на водородния пероксид (H→O-O←H) атомите водород също са от първа положителна степен на окисление. Кислородните атоми обаче тук са от първа отрицателна степен на окисление, а не както в молекулата на водата.
Чрез баланс на зарядите. Степените на окисление се определят, като се състави баланс на зарядите. Този метод изисква да се помни следното:
1. Елементите с метален химичен характер имат само положителна степен на окисление.

2. Флуорът има винаги (-1) степен на окисление.
3. Елементите с неметален характер в съединенията им с елементи с метален характер и с водорода имат отрицателна степен на окисление.
4. Водородът има положителна първа степен на окисление във всички съединения, с изключение на алкалните и алкалоземните хидриди.

5. В съединенията си кислородът винаги е отрицателна втора степен на окисление (-2). Изключение правят:

6. Висшата положителна степен на окисление на повечето елементи е равна на номера на групата от периодичната система, в която се намират.
Хлор – 7А група, степен на окисление +7
Сяра – 6А група, степен на окисление +6
Пример за пресмятане на степента на окисление:
Неизвестната степен на окисление се бележи с X. Състава се уравнение, като се следва правилото: Алгебричната сума от степените на окисление на всички атоми, изграждащи съединението, е равна на нула.
Степента на окисление за химичен елемент, влизащ в състава на сложен йон, се определя от правилото: Алгебричната сума от степените на окисление на всички атоми, изграждащи йона, е равна на заряда на йона.
ЛЮБОПИТНО: Думата валентност произлиза от латинската дума валенция, която означава сила. Английският химик Е. Франкланд създава учението за валентността.

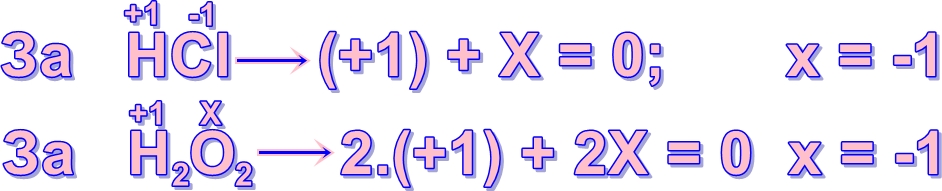


Изключително полезна и изчерпателна статия, обяснена е на разбираем и интересен език. Благодаря Ви !
Имате грешка в степените на окисление на кислорода в изключенията му – просто трябва да се разменят.