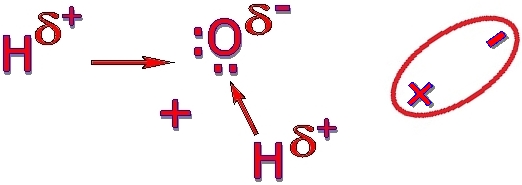Какво представлява ковалентната химична връзка?
Вече установихме, че в молекулите на водорода, на кислорода, на азота, на хлороводорода, на водата и други атомите се свързват чрез общи електронни двойки.
Химични връзки, които се осъществяват чрез общи електронни двойки, се наричат ковалентни химични връзки.
Видове ковалентни връзки.
Според броя на общите електронни двойки. Да разгледаме електронните формули на хлора, на хлороводорода, на водата и на азота (вижте ги тук). В молекулите на първите три вещества атомите са свързани с по една обща електронна двойка. Такива ковалентни връзки се наричат единични или прости.
Азотните атоми се свързват в молекулата на азота с три общи електронни двойки.
Ковалентни химични връзки, които се осъществяват с повече от една обща електронна двойка, се наричат сложни или кратни.
В молекулата на азота химичната връзка е сложна. Тя е тройна.
Според електроотрицателността на свързаните атоми. В молекулите на простите вещества H2, N2, Cl2 и други общите електронни двойки се привличат с еднаква сила от ядрата на свързващите се атоми, които са еднакви. Затова общите електронни двойки принадлежат в еднаква степен на двата атома. Химичната връзка в такива вещества е неполярна. Нарича се още атомна.
В молекулата на хлороводорода хлорният атом привлича с по-голяма сила общата електронна двойка, защото електроотрицателността му е по-голяма от тази на водорода. Ето защо хлорният атом придобива частичен отрицателен електричен заряд. Отбелязва се като степен след химичния знак с гръцката буква делта и след нея се записва знакът на заряда – (+) или (-). За хлора в молекулата на хлороводорода означението е Clδ- Водородният атом, който привлича по-слабо общата електронна двойка в молекулата на хлороводорода, се натоварва частично положително (Hδ+ ).
Такава ковалентна химични връзка, при която общата електронна двойка е изтеглена към единия атом, се нарича полярна.
Изтеглянето на двойката електрони към единия атом се означава със стрелка (Hδ+→Clδ-). Колкото разликата в електроотрицателността на свързващите атоми е по-голяма, толкова химичната връзка е по-силно полярна.
Характеристика на молекулите с ковалентна химична връзка по полярност.
При двуатомни молекули. В двуатомните молекули на простите вещества химичните връзки са неполярни а атомите на химичните елементи нямат електричен заряд.
Молекули, в които химичните връзки са неполярни, също са неполярни.
Вече уточнихме, че химичната връзка в молекулата на хлороводорода е ковалентна полярна. Частично положително зареденият водороден атом е център на положителен заряд в молекулата, а частично отрицателно зареденият хлорен атом – центът на отрицателен заряд. Центърът на положителния заряд в хлороводородната молекула не съвпада с центъра на отрицателния.
Молекули, в които центърът на положителните и на отрицателните заряди не съвпада, се наричат полярни.
Молекулата на хлороводорода е полярна.
Полярните молекули се наричат още диполи.
При многоатомни молекули. При многоатомните молекули определянето на полярността на молекулата е по-сложно. Освен разпределението на зарядите се отчита и пространственото разположение на атомите в молекулата. Например:
1. В молекулата на въглеродния диоксид (СО2) въглеродният атом и двата кислородни атома са подредени в права линия. Химичните връзки сключват ъгъл 180 градуса (вижте фигура 1.13. а,б).
Центърът на положителните заряди е при въглеродния атом. Къде е центърът на отрицателните заряди? Въпреки че двата кислородни атома са частично отрицателно заредени, центърът на отрицателните заряди съвпада с центъра на положителните заряди. Затова молекулата на въглеродния диоксид е неполярна.
2. В молекулата на водата химичните връзки между водородните и кислородния атом сключват помежду си ъгъл от 104°30′. Центърът на положителните заряди е някъде между двата водородни атома, но не съвпада с центъра на отрицателните заряди, определен от кислородния атом. Ето защо в молекулата на водата има два полюса – на положителен и на отрицателен електричен заряд. Водната молекула е дипол (вижте фигура 1.14.).
Междумолекулни взаимодействия. Между неполярните молекули съществуват много слаби сили на взаимодействие. Ето защо веществата, които са изградени от такива молекули, обикновено са в газообразно състояние.
Между разноименните полюси на диполите действат електростатични сили на привличане. Те са толкова по-големи, колкото полярността на молекулите е по-голяма. Какви са например силите, които действат между диполите на водата?
Молекулите на водата са силно полярни. Водородният атом, който участва с единствения си електрон в общата електронна двойка, вече има частичен положителен заряд и се привлича от неподелената електронна двойка на кислороден атом на съседна молекула вода. Така между двата дипола се поражда връзка, която се означава като водородна. Тази връзка е по-слаба от ковалентната връзка, но е много по-здрав от обикновените междумолекулни сили (вижте фигура 1.15.).
Водородните връзки определят до голяма степен разтворимостта, температурата на топене, температурата на кипене на веществата и пр. Те влияят на формата и устойчивостта на кристалните решетки. Извънредно голямо е и биологичното им значение. Водородните връзки определят до голяма степен сложната структура на белтъците.
При разтваряне на вещества със силно полярни връзки във вода се извършва следния процес: ковалентната силно полярна връзка се разкъсва под влияние на диполите на в одата и се образуват йони. Например във вода хлороводородът (HCl) се разпада на H+ и Cl–. Процесът се изразява с уравнениeто: HCl → H+ + Cl–