Периодичен закон. През 1869 г. Големият руски учен Д. И. Менделеев, правейки опит да систематизира познатите по негово време химични елементи, прозря, че с нарастването на относителните атомни маси свойствата на химичните елементи и на съединенията им се изменят периодично.
Периодичен закон. През 1869 г. Големият руски учен Д. И. Менделеев, правейки опит да систематизира познатите по негово време химични елементи, прозря, че с нарастването на относителните атомни маси свойствата на химичните елементи и на съединенията им се изменят периодично.
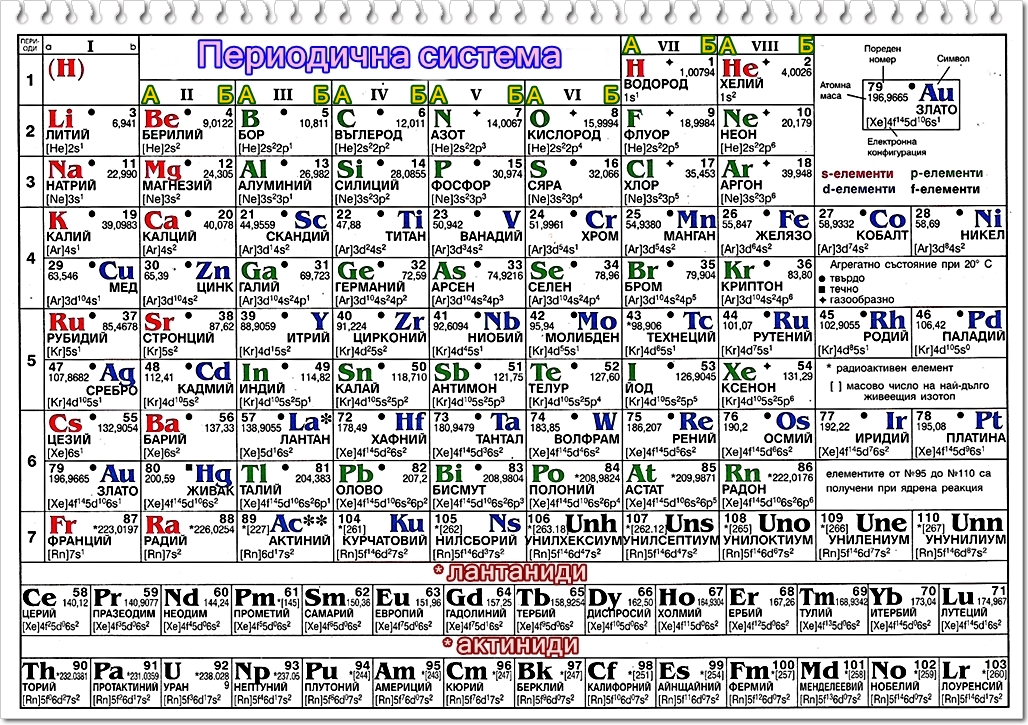
На основата на открития от него природен закон той създаде пълната естествена класификация на химичните елементи – периодичната система. Тя е табличен израз на периодичен закон. По-късно е установено, че в нея всеки елемент заема място, определено от броя на протоните в ядрото му. Прието е поредният номер на елемента да се бележи със Z.
Откриването на периодичния закон е едно от най-големите обобщения не само в химичната наука, но и в цялото естествознание.
Структура на периодичната система. Периодичната система се състои от 7 периода и 8 групи.
Периодът е хоризонтален ред от химични елементи, подредени по възходящ ред на относителните им атомни маси, чиито свойства закономерно се изменят. Всеки период, с изключение на първия, започва с алкален елемент и завършва с благороден елемент.
Първи, втори и трети период се състоят от по един ред. Наричат се малки периоди. Първият ред съдържа 2 елемента, а вторият и третият по осем. Четвърти, пети и шести период се състоят от по два реда и съдържат съответно по 18 и 32 елемента. Те са големи периоди. Седмият период е незавършен.
Химичните елементи с номера от 58 до 71 имат свойства, които са много сходни със свойствата на лантана и трябва да се поместят в неговата клетка. Те се наричат лантаноидни и са изведени в отделен ред. Аналогично е разположението и на елементите с поредни номера от 90 до 103. Те са наречени актиноидни, защото свойствата им са много сходни с тези на актиния.
Периодична система – група в периодичната система:
Това е вертикален ред от химични елементи, подредени по възходящ ред на относителните им атомни маси. Всяка група се състои от две подгрупи: главна подгрупа или А група, и вторична подгрупа или Б група.
А групите са изградени от елементи от малките и от големите периоди. В 8А група са разположени благородните елементи
Б групите включват елементи само от големите периоди. Тези елементи се наричат преходни елементи. Елементите от 8Б група са подредени в три хоризонтали реда, наречени триади. Групите включват елементи със сходни свойства.
Характеристика на химичните елементи по периоди и по групи.
Характерът на химичните елементи и свойствата на техните съединения се изменят закономерно в периодичната система.
В периодите с увеличаване на относителните атомни маси на елементите химичният им характер се променя от метален към неметален. Металният характер постепенно отслабва, а неметалният се засилва. Химичната активност на атомите на елементите към кислорода отслабва, а към водорода се засилва.
В А групите с увеличение на относителните атомни маси на химичните елементи техният метален характер се засилва. Нараства химичната им активност към кислорода и към неметалите. Не металният химичен характер на елементите от главните подгрупи, обратно отслабва. Постепенно отслабва химичната активност на атомите на елементите към водорода и към металите.
Химичните елементи с най-силно изразен метален характер се намират в левия долен ъгъл на периодичната система, а с най-силно изразен неметален – в десния горен ъгъл.
Химичните елементи с метален характер образуват прости вещества метали, основни оксиди и хидроксиди, а водородните им съединения (хидриди) са с йонен строеж.
Химичните елементи с неметален характер образуват прости вещества неметали, техните оксиди са киселинни и на тях им отговарят кислородсъдържащи киселини. Те образуват водородни съединения с молекулен строеж.
Простите вещества на елементите с двойствен характер са метали. Те образуват амфотерни оксиди и хидроксиди.
По периодите от ляво на дясно свойствата на оксидите се променят постепенно от основни към киселинни. Закономерно се изменя и валентността на елементите. Висшата валентност на елементите към кислорода съвпада с номера на групатa, а валентността на елементите спрямо водорода расте от първа до четвърта, след което намалява до първа.