Знанията за строежа на електронната обвивка на атомите позволяват да се обяснят закономерностите в периодичната система. От друга страна, по данни от периодичната система могат да се изграждат атомни модели. Какви са закономерностите между строежа на атома и мястото на елемента в периодичната система?
Връзката между строежа на електронната обвивка на атома на даден химичен елемент и номера на периода, в който той се намира. Вижте таблица 1.14.
Броя на електронните слоеве в електронната обвивка на атома съвпада с номера на периода, в който се намира елементът.
Периодът е хоризонтален ред от химични елементи в периодичната система, чиито атоми съдържат еднакъв брой електронни слоеве.
Химичните елементи в периодите са подредени по възходящ ред на броя на протоните в ядрата им.
Първият елемент на всеки период (с изключение на първия период) е алкален елемент. Атомите на алкалните елементи съдържат по един електрон във външния си електронен слой. Всеки алкален елемент поставя началото на изграждането на нов електронен слой.
Последният елемент на всеки период е благороден елемент. Външният електронен слой на атомите на всеки благороден елемент съдържа осем електрона (с изключение на хелия).
В малките периоди се изгражда само външния електронен слой на атомите. Затова първия период може да има само два химични елемента, във втория и в третия – по 8. В големите периоди (4,5,6 и 7) броят на елементите по-големи от (18, 32) поради по-сложното запълване на електронната обвивка на атомите им.
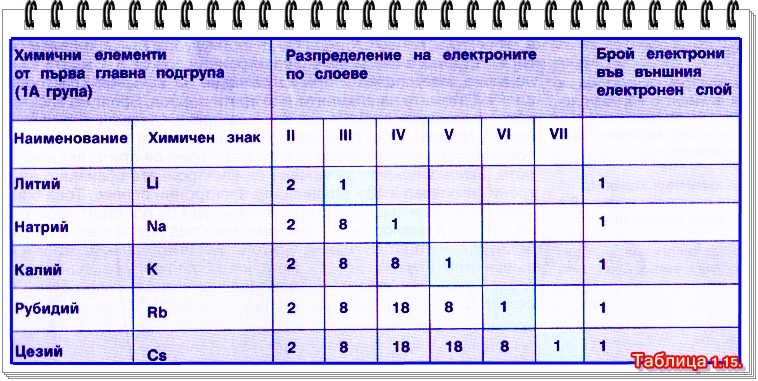
Връзката между строежа на електронната обвивка на атома на даден химичен елемент и номера на А групата, в която той се намира. Ако сравним строежа на атомите на химичните елементи от първа главна подгрупа (вижте таблица 1.15.), установяваме, че те имат по един електрон във външния си електронен слой.
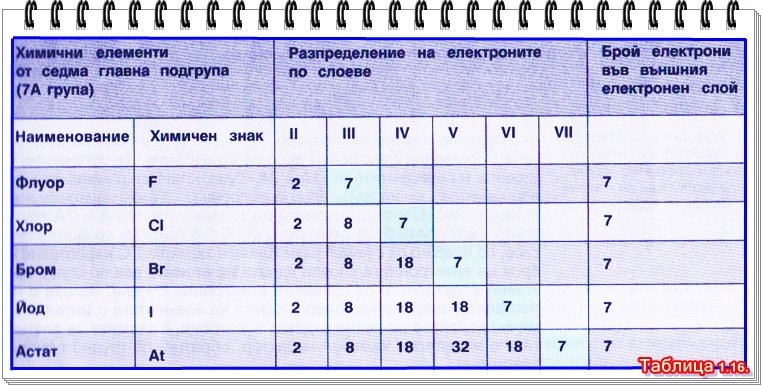
Химичните елементи от седма главна подгрупа имат по седем електрона във външния електронен слой (вижте таблица 1.16.).
Същата закономерност се наблюдава и при атомите на останалите елементи от главните подгрупи на периодичната система.
Броят на електроните във външния електронен слой на атома съвпада с номера на главната подгрупа, в която се намира елементът.
Главна подгрупа (А група) се нарича вертикален ред от химични елементи е периодичната система, подредени по възходящ ред на броя на протоите в ядрата им, чиито атоми имат завършени вътрешни електронни слоеве с 2, 8, 18 или 32 електрона и еднакъв брой електрони във външния си електронен слой.
Максималният брой електрони във външния електронен слой е осем, затова главните подгрупи в периодичната система са осем,
Коя е причината за периодичността в изменението на свойствата на елементите?
Да проследим как са изградени външните електронни слоеве на атомите на елементите от втори период. При атома на лития Li броят на електроните във външния електронен слой е 1. При атома на берилия Be – 2, при бора В – 3, при въглерода С – 4, при азота N – 5, при кислорода O– 6, при фосфора F – 7и при неона Ne електроните във външния електронен слой са 8. Същата закономерност се спазва и при изграждане на външния електронен слой на атомите на елементите от трети период. Броят на електроните от външния електронен слой на всеки следващ елемент, от натрия Na до аргона Ar, нараства постепенно от 1 до 8. Нараства постепенно и силата, с която тези електрони се притеглят към ядрото. Закономерното запълване на електронната обвивка с електрони се спазва и при следващите електронни слоеве. Това означава, че едни и същи електронни структури се повтарят периодично. Затова в периодичната система един под други – в една и с съща подгрупа, попадат елементи, чиито атоми имат еднакъв строеж на външния си електронен слой. Например строежът на външния електронен слой на атома на кислорода O се повтаря и при атома на сярата S, и при атома на селена Se.
Сходството в строежа на външния електронен слой на атомите на елементите от една и съща главна група определя сходството в техния химичен характер, общия тип съединение, които образуват, и сходство в техните химични свойства.
Ако сравним химичния характер на елементите и броя на електроните от външния електронен слой на атомите им, ще установим, че атомите на елементите от 1А и 2А група, които са с метален химичен характер, имат малък брой електрони (1,2) във външния си електронен слой, Обратно, атомите на елементите от 6А и 7А група които имат голям брой електрони (6, 7) във външния си електронен слой, по правило са с неметален химичен характер. С нарастване на броя на електронните слоеве ядрата на атомите все по-слабо привличат електроните от външните електронни слоеве. Затова с нарастване на поредния номер атомите на елементите с метален химичен характер по-лесно отдават електрони, а атомите на елементите с неметален химичен характер, обратно, по-трудно приемат електрони.
Периодичното повторение на еднакви структури в електронната обвивка на атомите на химичните елементи е причината за периодичното изменение на химичния им характер.