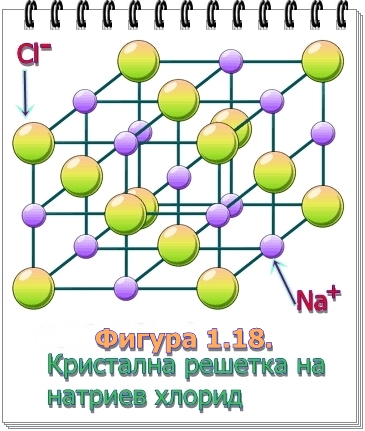
 Същност на йонната връзка. При взаимодействие на метала натрий с газообразен хлор протича много бурна реакция. Получава се кристалното вещество – натриев хлорид (вижте фигура 1.18.).
Същност на йонната връзка. При взаимодействие на метала натрий с газообразен хлор протича много бурна реакция. Получава се кристалното вещество – натриев хлорид (вижте фигура 1.18.).
Да обясним образуването на химичната връзка във веществото натриев хлорид. Единичният електрон на натрият и единичният електрон на хлора, които имат противоположни спинове, образуват обща електронна двойка.
От приложението се вижда, че електроотрицателността на хлора е много по-голяма от тази на натрия (χ(Cl)>>χ(Na)). Ето защо общата електронна двойка почти изцяло е изтеглена към атомите на хлора.
Практически атомът на натрия загубва валентния си електрон и се превръща в положителен йон. Хлорният атом от своя страна присъединява един електрон към външния си електронен слой и се превръща в отрицателен йон. Протеклият процес е равностоен на прескачане на електрон от натрия към хлора.
Между двете противоположно заредени частици – положителен натриев йон и отрицателен хлориден йон, действат електростатични сили на привличане. Химичната връзка се осъществява между противоположно заредени йони. Такава връзка се нарича йонна химична връзка.
Йонна химична връзка се образува, когато разликата в електроотрицателностите на двата свързващи се атома е много голяма. Йонна химична връзка се осъществява между елемент с метален и елемент с неметален химичен характер.
Атоми и йони. Нека обобщим: Атомите на натрия, както и на другите химични елементи с метален характер имат малък брой електрони във външния си електронен слой. Те много лесно ги отдават на атомите на елементите с неметален характер. Така металните атоми се превръщат в положителни йони. Положителният заряд на йона се определя от броя на отдадените електрони.
Атомите на хлора, както и на другите елементи с неметален характер имат сравнително голям брой електрони във външния си електронен слой. Атомите на тези елементи приемат електрони и се превръщат в отрицателни йони. Големината на отрицателния заряд е числено равна на броя на приетите електрони.
Доказателство, че строежът на натриевите и на хлорните атоми е различен от този на съответните йони, е разликата в свойствата на частичките:
- Хлорните йони (Cl–) образуват със сребърните йони (Ag+) бяла утайка от сребърен хлорид AgCl;
- Натриевите атоми енергично взаимодействат с неметали, с кислород, с вода, с киселини, докато натриевите йони (Na+) не притежават подобни свойства.
Йонни съединения. Противоположно заредените натриеви и хлоридни йони се подреждат правилно в пространството и образуват йонна кристална решетка. Веществата с йонна кристална решетка се наричат йонни съединения.
 На фигура 1.19. е представен модел на кристал от натриев хлорид. От самата фигура се вижда, че всеки натриев йон е обграден от шест хлоридни йона и обратно. Броят на положителните е равен на броя на отрицателните йони. В йонните съединения няма молекули. Химичните формули на йонните съединения изразяват само най-простото съотношение между различните йони в кристала.
На фигура 1.19. е представен модел на кристал от натриев хлорид. От самата фигура се вижда, че всеки натриев йон е обграден от шест хлоридни йона и обратно. Броят на положителните е равен на броя на отрицателните йони. В йонните съединения няма молекули. Химичните формули на йонните съединения изразяват само най-простото съотношение между различните йони в кристала.
Под влияние на диполните молекули на водата йонната кристална решетка се разпада и във воден разтвор йонните съединения се намират под формата на йони. Процесът на разпадане на натриевия хлорид (NaCl) във вода до Na+ и Cl– се изразява с уравнението NaCl → Na+ Cl–
ЛЮБОПИТНО: За пръв път немският физик В. Косел дава обяснение на свързването на атоми чрез йонна химична връзка. Като съпоставя броя на електроните във външния електронен слой на атомите на елементите с тяхната реактивоспособност, той прави заключението, че осемелектронният външен електронен слой е най-стабилен. Ето защо атомите се стремят да го придобият, като отдават или приемат електрони и се превръщат в йони. Йоните се свързват помежду си с електрични сили.


