Особености на ензимите като биокатализатори. Механизъм на ензимното действие. Ензим-субстратен комплекс. Специфичност на ензимната катализа.
- Характерна особеност на ензимната катализа – формирането на ES комплекс.
- Ензимно-катализираната реакция протича през няколко междинни етапа: S + E → ES → EP → P + E
- Свързването на ензима със субстрата става в т.н. каталитичен (активен) център.
- ES съществува само по време на реакцията, след което се разгражда. Образувалите се връзки най-често са слаби, но е възможно формиране и на ковалентни комплекси.
Особености на АЦ
- Триизмерна структура, образувана при пространственото нагъване на ензимната белтъчна молекула при формиране на третичната и/или четвъртична структура.
- Включват се АК остатъци и от отдалечени участъци на ППВ, а може и от други субединици (при олигомерните ензими).
- При двукомпонентните ензими, кофакторите участват при формирането на АЦ.
- Връзките на АЦ със субстрата обикновено са слаби (водородни, йонни, хидрофобни и др.). В някои случаи са ковалентни (трансаминази).
- Свързването на субстрата в АЦ води до намалява активиращата енергия.
- Обикновено една ензимна молекула има 1 АЦ, но са известни ензими, които катализират повече от един тип реакции – вероятно имат повече от 1 АЦ (или АЦ е много сложен). При някои олигомерни ензими, се срещат повече идентични АЦ.
Специфичност на ензимната катализа
Реакционна специфичност – определя се от апоензима
Субстратна специфичност:
- Строга специфичност – аргиназа, глюкокиназа
- Групова – фосфомоноестерази, фосфодиестерази, екзопептидази, ендопептидази (пепсин, трипсин, химотрипсин)
- По отношение на връзката – липази
- Стереоспецифичност – L-AAO, D-AAO,
- Специфиичност по отношение на геометричните изомери – фумараза
Кинетика на ензимните реакции. Фактори влияещи на скоростта на ензимните реакции: концентрация на ензима и субстрата, температура, рН, активатори и инхибитори.
Ензимна кинетика
- Ензимна кинетика – раздел от химичната кинетика, която изучава зависимостта на скоростта на ензим-катализираните реакции от химичната природа на реагиращите вещества (S + E), и от условията на взаимодействието им (концентрация, температура, pH, активатори, инхибитори).
- Скоростта на ензим-катализираните реакции се измерва:
С намалението на [S] за единица време;
С нарастването на продукта за единица време.
Влияние на концентрацията на ензима [E]
- V0 е право пропорционална на концентрацията на ензима. При много високи [E] тази линейна зависимост се губи.
- На базата на тази линейност при равни други условия по скоростта на ензимната реакция се определя количеството Е.
Единици за определяне количество ензим
- Международна ензимна единица (U) – това количество Е, което превръща 1 µmol S за 1 min.
- Катал (cat)- това количество Е, което превръща 1 mol S за 1 s. 1 cat=6.107 U, т.е. 1U=16,67 ncat
- Специфична активност – Ензимните единици отнесени към 1 mg Е белтък.
- Концентрация на ензим – Ензимните единици в литър биологична течност или разтвор (U/l).
Влияние на концентрацията на субстрата [S]
- Km – Константа на Михаелис – отразява сродството на ензима спрямо субстрата (обратно пропорционална зависимост) – колкото Km е по-висока, толкова сродството на Е спрямо S e по-малко и обратно. Km най-често е в границите на 10-2 до 10-5 mol/l.
- Vmax – отразява стабилността на ES комплекс- (обратно пропорционална зависимост)- колкото Vmax е по-малка, толкова стабилността на ES е по-голяма и обратно.
Влияние на температурата (t0)
1.Топт зависи от продължителността на температурното въздействие.
2.Ензимите са различно чувствителни към температурата: определя се основно от структурата им.
- Еднокомпонентните са по-стабилни,
- Ензими с третична структура поддържана и от ковалентни връзки (S-S) са по-стабилни
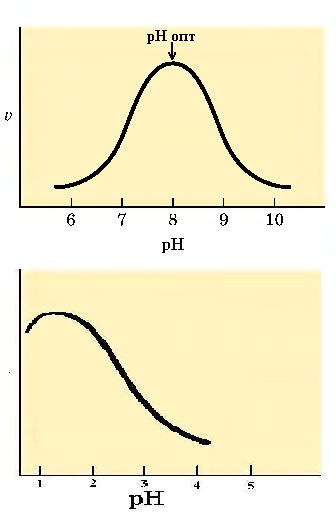
Влияние на киселинността на средата (pH)
1.pH на средата повлиява сродството между Е и S (Km) и стабилността на ES комплекс (Vmax)
2.pHопт зависи от както от АК ц АЦ на ензима (ако са полярни или дисоцииращи се), така и от наличието на дисоцииращи се групи в субстратните молекули
3.Ензими имащи различни субстрати с различни дисоцииращи се, показват различни pH-оптимуми за всеки от тях:
Необратими инхибитори на ензимното действие
Неспецифични необратими (химични агенти)
- фосфороорганични невропаралитични отрови (инхибират серинови ензими) –
- органоживачни съединения (инхибират тиолови ензими) –
- алкилиращи агенти (инхибират тиолови ензими) –
- арсенови производни (инхибират тиолови ензими) –
- тежки метали (инхибират тиолови ензими) – Hg, Pb
Инхибитори на кофактори на ензимите
- блокират алдехидни групи (в ПФ) –
- свързват Вит. Н (биотин) – авидин в яйчния белтък
Инхибиторни пептиди от молекулата на ензимите – проензими
Обратими инхибитори на ензимното действие
Конкурентни (компетитивни) инхибитори
- Структурни аналози на субстрата (антиметаболити)
- Реагират само със свободен ензим
- Свързват се в АЦ на ензима
- Конкурират се със субстрата за АЦ на ензима
- Степента на инхибиране зависи от съотношението между концентрацията на S и I
Автор на статията: Доц. Татяна Влайкова!